| 中考复习指导--三大类化学计算分析和练习(3) |
|---|
| http://www.sina.com.cn 2005/01/28 23:23 北京四中网校 |
|
(三)有关溶液的计算 溶液是一种或几种物质分散到另一种物质里形成均一、稳定的混合物,在有关溶液的计算中,要准确分析溶质、溶剂、溶液的质量,它们的最基本的质量关系是: 溶质质量+溶剂质量=溶液质量 应注意此关系中,溶质质量不包括在溶液中未溶解的溶质的质量。 1.溶液中溶质质量分数的计算 溶质的质量分数是溶质质量与溶液质量之比。初中化学中常用百分数来表示。溶液中溶质质量分数的计算式如下: 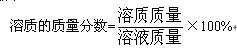 溶质质量分数的计算题可以有: (1)已知溶质和溶剂质量,求溶质质量分数。 (2)已知溶液质量和溶质质量分数,求溶液中所含溶质和溶剂质量。 (3)将一已知溶质质量分数的溶液加入一定量的水进行稀释,或加入固体溶质,求稀释后或加入固体后所得溶液的溶质质量分数。 2.溶解度与溶质质量分数之间的换算 在一定温度下,饱和溶液里溶质质量、溶剂质量、溶液质量之比,是一个固定的值,也就是说饱和溶液里溶质质量分数是恒定的。在计算中首先要明确溶解度与溶液质量分数两个概念的本质区别。其次是要注意条件,必须是在一定温度下的饱和溶液,才能进行换算。 溶解度与溶质质量分数的比较如下:  3.溶质质量分数与化学方程式的综合计算 原则:代入化学方程式计算的数据是必须是纯物质的质量。 要求认真审题,充分挖掘题目所给的信息,根据已知条件,找到解题的突破点,再按照题目设问求解。 例 现有一含杂质的固体氯化钡样品(杂质不溶于水)。取12.5g样品放入烧杯中,然后加入39.6g水使其充分溶解,静置后滤去杂质。取10g滤液,加入足量的硝酸银溶液,完全反应后生成沉淀2.87g。试求:(1)滤液中溶质的质量分数;(2)样品中氯化钡的质量分数。(计算结果精确到0.1%) 该题突破点在生成沉淀2.87g,由此可求出10g滤液中含有的氯化钡质量,从而进一步求出滤液的溶质质量分数。根据溶液的均一性,滤液中各部分溶质质量分数相同,则由10g滤液中溶质质量、溶剂质量之比,可求出39.6g水中溶解了多少氯化钡,即为12.5g样品中氯化钡质量。 (1)设10g滤液中含氯化钡的质量为x。  |
| 新浪首页 > 新浪教育 > 北京四中网校辅导专栏 > 正文 |
|
| 新 闻 查 询 |
|
|
|
|||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
教育频道意见反馈留言板 电话:010-82628888-5227 欢迎批评指正
新浪简介 | About Sina | 广告服务 | 联系我们 | 招聘信息 | 网站律师 | SINA English | 会员注册 | 产品答疑
Copyright © 1996 - 2005 SINA Inc. All Rights Reserved
版权所有 新浪网![]() 北京市通信公司提供网络带宽
北京市通信公司提供网络带宽







