不支持Flash
|
常见元素的单质及其重要化合物(二)
4.其他常见的金属(如:Fe、Al)
(1)了解金属的通性及金属冶炼的一般原理。初步了解金属的回收和资源保护。
(2)掌握Fe和Al的化学性质。
(3)了解常见金属的活动顺序。
(4)以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,理解变价金属元素的氧化还原性。
(5)了解铝的重要化合物。
(6)初步了解合金的概念。
5.了解在生活和生产中常见的无机化合物的性质和用途。
6.以上各部分知识的综合应用。
【试题举例】下列有关工业生产的叙述正确的是( )
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶液铜的质量比阴极析出铜的质量小
【答案】D
【解析】A中分离液氨只能使逆反应速度降低,未影响正反应速度。B中热交换装置利用的是SO2催化氧化放出的热量。C中Cl2在阳极生成。D电解精炼铜时阳极含有杂质,杂质金属如铁能失去电子进入溶液,同时铜离子得到电子在阴极析出,因此D正确。
【试题举例】某课外小组对一些金属单质和化合物的性质进行研究。
(1)下表为“铝与氯化铜溶液反应”实验报告的一部分:
|
实验步骤 |
实验现象 |
|
将打磨过的铝片(过量)放入一定浓度的CuCl2溶液中 |
产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
|
反应结束后分离出溶液备用 |
|
|
红色固体用蒸馏水洗涤后,置于潮湿空气中 |
一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
按反应类型写出实验中发生反应的化学方程式各一个(是离子反应的只写离子方程式)
置换反应:________________________________________________________________________;
化合反应:________________________________________________________________________。
(2)用石墨作电极,电解上述实验分离出的溶液,两极产生气泡。持续电解,在阴极附近的溶液中还可以观察到的现象是____________________。解释此现象的离子方程式是____________________。
(3)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼金属锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示)________________________________。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是________________。
【答案】(1)2Al+6H+===2Al3++3H2↑或2Al+3Cu2+===2Al3++3Cu
2Cu+O2+H2O+CO2===Cu2(OH)2CO3
(2)白色沉淀生成,后沉淀逐渐溶解至消失
Al3++3OH-===Al(OH)3↓
Al(OH)3+OH-===AlO2+2H2O
(3)①3MnO2+4Al=(高温)3Mn+2Al2O3
②MnO2+H2O2+2H+===Mn2++O2↑+2H2O
【解析】氯化铜中Cu2+发生水解使溶液显酸性:Cu2++2H2OCu(OH)2↓+2H+,铝会与酸反应生成氢气:2Al+6H+===2Al3++3H2↑,或与Cu2+发生置换反应:2Al+3Cu2+===2Al3++3Cu;生成的氯化铝溶液电解,会生成氢气、氯气,水的电离平衡发生移动,还会使溶液显碱性:2Cl-+2H2O===2OH-+H2↑+Cl2↑,生成的碱与铝离子反应:Al3++3OH-===Al(OH)3↓、Al(OH)3+OH-===AlO2+2H2O;适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,可判断H2O2被氧化为O2,该反应的离子方程式是MnO2+H2O2+2H+===Mn2++O2↑+2H2O。
【试题举例】U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
(1)V的单质分子的结构式为__________;XW的电子式为__________;
Z元素在周期表中的位置是__________。
(2)U元素形成的同素异形体的晶体类型可能是(填序号)__________。
①原子晶体 ②离子晶体 ③分子晶体 ④金属晶体
(3)U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)__________;V、W的氢化物分子结合H+能力较强的是(写化学式)__________,用一个离子方程式加以证明____________________________。
(4)YW2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为____________________________________,由此可知VW和YW2还原性较强的是(写化学式)__________。
【答案】(1)NN Mg2+[ ]2- 第四周期第Ⅷ族
(2)①③
(3)CH4 NH3 NH3+H3O+===NH4+H2O
(4)3SO2+2NO3+3Ba2++2H2O===3BaSO4↓+2NO+4H+ SO2
有机化学基础
1.了解有机化合物数目众多和异构现象普遍存在的本质原因。
2.理解基团、官能团、同分异构体、同系物等概念。能够识别结构式(结构简式)中各原子的连接次序和方式、基团和官能团。能够辨认同系物和列举同分异构体。了解烷烃的命名原则。
3.以一些典型的烃类化合物为例,了解有机化合物的基本碳架结构。掌握各类烃(烷烃、烯烃、炔烃、芳香炔)中各种碳碳键、碳氢键的性质和主要化学反应。
4.以一些典型的烃类衍生物(乙醇、溴乙烷、苯酚、甲醛、乙醛、乙酸、乙酸乙酯、脂肪酸、甘油酯、多羟基醛、氨基酸等)为例,了解官能团在化合物中的作用。掌握各主要官能团的性质和主要化学反应。
5.了解石油化工、农副产品化工、资源综合利用及污染和环保的概念。
6.了解在生活和生产中常见有机物的性质和用途。
7.以葡萄糖为例,了解糖类的基本组成和结构、主要性质和用途。
8.了解蛋白质的基本组成和结构、主要性质和用途。
9.初步了解重要合成材料的主要品种的主要性质和用途。理解由单体通过聚合反应生成高分子化合物的简单原理。
10.通过上述各类化合物的化学反应,掌握有机反应的主要类型。
11.综合应用各类化合物的不同性质,进行区别、鉴定、分离、提纯或推导未知物的结构简式。组合多个化合物的化学反应,合成具有指定结构简式的产物。
【导读】本部分内容近几年来以选择题和有机推断为主。重点有:有机物的燃烧规律,有机反应类型,官能团的性质和转化,同分异构体的书写等。复习时要联系生产、生活、科技、环保等领域。
【试题举例】仔细分析下列表格中烃的排列规律,判断排列在第15位的烃的分子式是( )
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
…… |
|
C2H2 |
C2H4 |
C2H6 |
C3H4 |
C3H6 |
C3H8 |
C4H6 |
C4H8 |
C4H10 |
…… |
A.C6H12 B.C6H14 C.C7H12 D.C7H14
【答案】B
【解析】观察,序列中每3个一组,重复着CnH2n-2,CnH2n,CnH2n+2(假设n=m+1,第一组m=1)的分子式。第15位为第5组中的第3个,满足CnH2n+2的分子式,且n=m+1=5+1=6,故分子式为C6H14。
【试题举例】莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是( )
OHHOHOCOOH OHHOHOCOOH
A.两种酸都能与溴水反应
B.两种酸遇三氯化铁溶液都显色
C.鞣酸分子与莽草酸分子相比多了两个碳碳双键
D.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
【答案】AD
【解析】莽草酸中含有碳碳双键,能与溴水发生加成反应;鞣酸中酚羟基邻位碳上有氢原子,能与溴水发生取代反应,选项A正确。莽草酸分子中无酚羟基,遇三氯化铁溶液不显色,选项B错。鞣酸分子苯环中的碳碳键不是普通碳碳双键,而是介于单键和双键之间的一种特殊的化学键,选项C错。1 mol莽草酸、鞣酸分别含有4 mol羟基,与足量金属钠反应都可产生氢气2 mol,选项D正确。
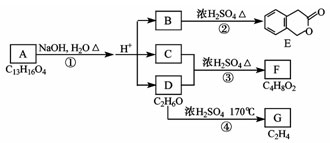
【试题举例】下图中A、B、C、D、E、F、G均为有机化合物。
根据上图回答问题:
(1)D的化学名称是__________。
(2)反应③的化学方程式是____________________。(有机物须用结构简式表示)
(3)B的分子式__________。A的结构简式是__________。反应①的反应类型是__________。
(4)符合下列3个条件的B的同分异构体数目有__________个。
ⅰ)含有邻二取代苯环结构 ⅱ)与B有相同官能团 ⅲ)不与FeCl3溶液发生显色反应
写出其中任意一个同分异构体的结构简式:________________________________________________________________________。
(5)G是重要的工业原料,用化学方程式表示G的一种重要的工业用途:____________________。
【答案】(1)乙醇
(2)CH3CH2OH+CH3COOH―→浓硫酸△CH3COOCH2CH3+H2O
(3)C9H10O3
CH2COOCH2CH3CH2OOCCH3 水解反应
(4)3 COOHCHCH3OHCH3CHCOOHOHCOOHCH2CH2OH(任写一个即可)
(5)nCH2===CH2―→催化剂加热、加压CH2—CH2
或CH2===CH2+H2O―→催化剂加热、加压CH3CH2OH(任写一个即可)
Ⅲ.命题要求
要以能力测试为主导,考查学生对所学相关课程基础知识、基本技能的掌握程度和综合运用所学知识分析、解决问题的能力。要重视理论联系实际,关注科学技术、社会经济和生态环境的协调发展;要重视对考生科学素养的考查。
更多高考信息请访问:新浪高考频道 高考论坛 高考博客圈 高考贴吧
特别说明:由于各方面情况的不断调整与变化,新浪网所提供的所有考试信息仅供参考,敬请考生以权威部门公布的正式信息为准。